Осмотическое
давление (обозначается π) — избыточное гидростатическое
давление на раствор,
отделённый от чистого растворителяполупроницаемой
мембраной, при котором прекращается диффузия
растворителя через мембрану (осмос).
Это давление стремится уравнять концентрации обоих растворов вследствие встречной
диффузии молекул растворённого вещества и растворителя.
Мера градиента осмотического
давления, то есть различия водного потенциала двух растворов, разделённых полупроницаемой
мембраной, называется тоничностью.
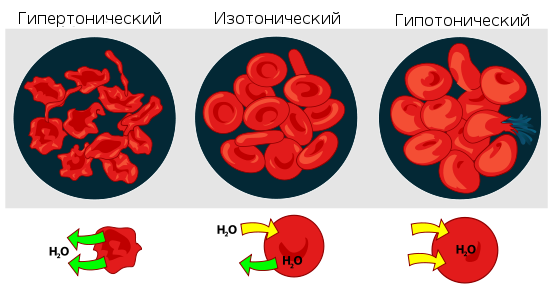
Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором,
называется гипертоническим, имеющий более низкое — гипотоническим.
Осмотическое давление
может быть весьма значительным. В дереве,
например, под действием осмотического давления растительный сок (вода с растворёнными
в ней минеральными веществами) поднимается по ксилеме
от корней
до самой верхушки. Одни только капиллярные
явления не способны создать достаточную подъёмную силу — например,
секвойям
требуется доставлять раствор на высоту до 100 метров. При этом в дереве движение
концентрированного раствора, каким является растительный сок, ничем не ограничено.
Если же подобный раствор
находится в замкнутом пространстве, например, в клеткекрови,
то осмотическое давление может привести к разрыву клеточной мембраны. Именно по
этой причине лекарства,
предназначенные для введения в кровь, растворяют в изотоническом
растворе, содержащем столько хлорида натрия
(поваренной соли), сколько нужно, чтобы уравновесить создаваемое клеточной жидкостью
осмотическое давление. Если бы вводимые лекарственные препараты были изготовлены
на воде или очень сильно разбавленном (гипотоническом по отношению к цитоплазме)
растворе, осмотическое давление, заставляя воду проникать в клетки крови, приводило
бы к их разрыву. Если же ввести в кровь слишком концентрированный раствор хлорида
натрия (3-5-10 %, гипертонические растворы), то вода из клеток будет
выходить наружу, и они сожмутся. В случае растительных
клеток происходит отрыв протопласта
от клеточной
оболочки, что называется плазмолизом.
Обратный же процесс, происходящий при помещении сжавшихся клеток в более разбавленный
раствор, — соответственно, деплазмолизом.
Величина осмотического
давления, создаваемая раствором, зависит от количества, а не от химической природы
растворенных в нём веществ (или ионов, если молекулы
вещества диссоциируют), следовательно, осмотическое давление является коллигативным
свойством раствора. Чем больше концентрация
вещества в растворе, тем больше создаваемое им осмотическое давление.
Это правило, носящее название закона осмотического давления, выражается простой
формулой.
Осмотическое давление,
которое зависит от содержания в растворе белков, называется онкотическим
(0,03 — 0,04 атм.). При длительном голодании, болезни почек концентрация белков
в крови уменьшается, онкотическое давление в крови снижается и возникают онкотические
отёки: вода переходит из сосудов в ткани, где πОНК больше.
При гнойных процессах πОНК в очаге воспаления возрастает в
2-3 раза, так как увеличивается число частиц из-за разрушения белков. В организме
осмотическое давление должно быть постоянным (≈ 7,7 атм.). Поэтому пациентам
вводят изотонические растворы (растворы, осмотическое давление которых равно πПЛАЗМЫ
≈ 7,7 атм. (0,9 % NaCl — физиологический раствор, 5 % раствор глюкозы).
Гипертонические растворы, у которых π больше, чем πПЛАЗМЫ, применяются
в медицине для очистки ран от гноя (10 % NaCl), для удаления аллергических
отёков (10 % CaCl2,
20 % глюкоза),
в качестве слабительных лекарств (Na2SO4∙10H2O,
MgSO4∙7H2O).
Закон осмотического
давления можно использовать для расчёта молекулярной
массы данного вещества (при известных дополнительных данных).
См. также
• Осмос
• Обратный осмос
• Осморегуляция
• Диффузионное давление
• Коллигативные свойства растворов
Литература
• Детлаф
А. А., Яворский Б. М. Курс физики: Учебное пособие для вузов — Москва:
Высшая школа, 1989. — с. 113
Категории: Осмос Физиология Биология Физическая химия Количество
вещества